Viết phương trình ion rút gọn của NaHCO3 NaOH của svnckh sẽ giúp các bạn biết cách viết phương trình rút gọn của các chất xảy ra phản ứng cũng như phương trình ion NaHCO3 tác dụng NaOH. Bài viết bao gồm các câu hỏi liên quan đến phương trình ion rút gọn của NaHCO3 NaOH, Mời các bạn cùng theo dõi.
Viết phương trình ion rút gọn NaHCO3 + NaOH
Nhỏ dung dịch NaHCO3vào ống nghiệm đựng dung dịch NaOH sẽ tạo thành phương trình phản ứng.
NaHCO3 + NaOH → Na2CO3 + H2O
Phương trình ion thu gọn
Na+ + HCO3−+ Na+ + OH− → 2Na+ + CO32− + H2O
HCO3− + OH− → CO32− + H2O
Tìm hiểu thêm :

Câu hỏi liên quan :
Câu 1 : viết pt phân tử , pt ion đầy đủ , pt ion rút gọn cho các phản ứng sau:
1, Na2CO3 + Ca(OH)2
2, CuSO4 +Na2S
3, NaHCO3 +HCl
4, NaHCO3 +NaOH
5, HClO+ KOH
6, FeS(r) +HCl
Hướng dẫn giải
1)Na2CO3+Ca(OH)2→CaCO3+2NaOH
2Na++CO32−+Ca2++2OH−→CaCO3+2Na++2OH−
CO32−+Ca2+→CaCO3
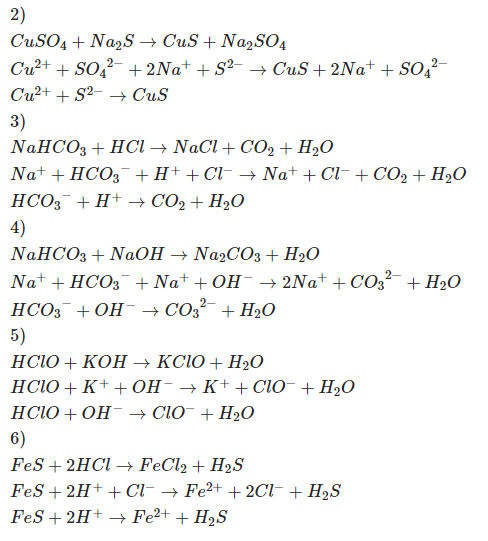
Câu 2 : Viết phương trình ion rút gọn của các phản ứng sau:
1) CO2 dư + KOH →
2) SO2 + Ca(OH)2 dư →
3) Fe3O4 + HCl →
4) MnO2 + HCl đặc →
5) Fe dư + H2SO4 đặc nóng →
Hướng dẫn giải
1) CO2 + 2KOH → K2CO3 + H2O
Phương trình ion: CO2+ 2K+ + 2OH- → 2K+ + CO32- + H2O
Phương trình ion thu gọn:
CO2 + 2OH- → CO32- + H2O
2) SO2+ Ca(OH)2 dư → CaSO3 + H2O
SO2 + Ca2+ → CaSO3
3) Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 8H+ → Fe2+ + 2Fe3+ + 4H2O
4) MnO2 + 4HCl → MnCl2 + Cl2+ 2H2O
MnO2 + 4H+ + 2Cl → Mn2+ + Cl2 + 2H2O
5) 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Fe + 4H+ + SO42- → Fe2+ + SO2 + 2H2O
Bài tập vận dụng
Bài 1 : Một dung dịch A chứa HCl và H2SO4 theo tỉ lệ mol 3:1. Dể trung hòa 100 ml dung dịch A cần 50 ml dung dịch NaOH 0,5M.
a. Tính nồng độ mol của mỗi axit
b. 200 ml dung dịch A trung hòa hết bao nhiêu ml dung dịch bazơ B chứa NaOH 0,2M và Ba(OH)20,1M?
Hướng dẫn giải
Phương trình hóa học
HCl + NaOH → NaCl + H2O (1)
H2SO4 + 2NaOH → Na2SO4 + 2H2O (2)
Theo phương trình (1), (2):
nNaOH = nHCl+ 2nH2SO4 = 3a + 2a = 0,5
→ a = 0,1 mol
+) nHCl= 0,3 → CM(HCl)= n/V = 0,3/0,1= 3M
+) nH2SO4= 0,1 →CM(H2SO4) = 0,1/0,1 = 1M
b/
+) Trong 200 ml ddung dịch A sẽ chứa: 0,6mol HCl và 0,2mol H2SO4
Phương trình hóa học:
HCl + NaOH → NaCl + H2O
H2SO4 + 2NaOH → Na2SO4+ 2H2O
2HCl + Ba(OH)2→ BaCl2 + H2O
H2SO4 + Ba(OH)2 → BaSO4 + H2O
Theo phương trình: nH+ = nOH−= 0.6 + 0,2.2 = 1 mol
+) Gọi thể tích B là: x ⇒ nNaOH= 0,2x;
nBa(OH)2 = 0,1x
⇒nOH− = 0,2x + 0,1x.2 = 0,4x = 1
⇒ x = 2,5 l ⇒x = 2,5 l
Bài 2 : Trộn 100 ml dung dịch NaOH 0,5M vào 100 ml dung dịch HCl 0,7M thu được dung dịch A. Tính pH của dung dịch A.
Hướng dẫn giải
nOH- = 0,1.0,5 = 0,05 mol
nH+ = 0,1.0,7= 0,07 mol
OH – + H+ → H2O
Lập tỉ lệ:
0,05/1 < 0,07/1
Vậy H+ dư
nH+ dư = 0,07 – 0,05 = 0,02 mol
[H+] = 0,02/0,2 = 0,1M
pH = -Log[H+] = 1
Bài 3 : Trộn 200 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,125M với 100 ml dung dịch hỗn hợp gồm NaOH 0,05M và Ba(OH)2 0,05M thu được dung dịch X. Dung dịch X có pH là bao nhiêu?
Hướng dẫn giải
∑nH+ =2.nH2SO4 + nHCl= 2.0,2.0,05 + 0,2.0,125 = 0,045 (mol)
∑nOH− = nNaOH + 2nBa(OH)2= 0,1.0,05 + 2.0,1.0,05 = 0,015 (mol)
H+ + OH- → H2O
0,015 ← 0,015
=> nH+ dư = 0,045 – 0,015 = 0,03 (mol)
=> [H+] = n: V = 0,03 : 0,3 = 0,1 M
pH = -log[H+] = 1